الكيمياء
لماذا
ندرس الكيمياء؟وبعض تطبيقاتها في الحياة؟
الكيمياء هو
علم دراسة التكوين(composition) والبناء(structure)، والخصائص(properties)، والتغيرات في المادة.
حيث ان :
تكوين المادة هو
ما يتعلق بالعناصر(elements) التي تحتوي عليها
تلك المادة.
اما بنية المادة
فهي طريقة ترتيب ذرات هذه العناصر في المادة .
اما الخصائص فهي أي سمة تعطي عينة من تلك المادة
هويتها المميزة عن غيرها من باقي العناصر .
فالكيمياء تعمل بشكل اساسي علي الذرات
والجزيئات في تفسير سلوك المواد وتطويرها وبما ان الذرة والجزئ هما المكون الأساسي
للكون لذا فإن الكيمياء ترتبط بكل شئ من حولنا سواء أكان في الصناعة ام في الحياة
البشرية
واليكم بعض تطبيقات الكيمياء في الحياة
الصورة توضح استخدام السيليكون في الواح الطاقة الشمسية لقدرته علي تخزين
الطاقة الشمسية في الروابط بين الجزيئات وفي الصورة الأخري حشرة النار التي ينتج
منها الضوء نتيجة تفاعلات كيميائية في جسم الحشرة والصورة التالية هي لوحة لفنان
استخدم فيها بعض الصبغات الكيميائية التي تحتفظ بلونها لسنوات. اما الأخيرة فهي
بعض المنتجات الكيميائية الصناعية والتي نستخدمها يوميا في حياتنا العادية.
الذرة
والجزئ في الكيمياء
الذرة هي
اصغر مكون للمادة والذي لايمكن تجزئته إلي ما هو اصغر واول من اطلق عليها هذا
الإسم كان علماء الإغريق القدماء.
اما
الجزئ فهو يتكون من اتحاد ذرتين او اكثر ويعتبر هو المكون الأساسي للمركبات
الكيميائية.
مفاهيم
عامة عن الكيمياء
-
تصنيف المواد
يمكن تلخيص تصنيف
المواد كيميائيا إلي:
1- مخلوط غير
متجانس.
2- مخلوط متجانس
ويطلق عليه محلول أيضا.
3- مادة نقية
(متجانسة او متشابهة) وتنقسم إلي مركب و عنصر .
-
خواص المواد
تنقسم إلي خواص
فيزيائية : والتي يمكن ملاحظتها بدون تغيير تركيب المادة او هويتها مثل اللون
والكثافة ودرجة الإنصهار ودرجة الغليان والصلابة والمرونة....إلخ.
خواص كيميائية:
وهي تصف الطريقة التي يمكن ا تتفاعل بها مادة أو تتغير لتكون مواد أخري مثل قابلية
الإشتعال في وجود الأكسجين(flammability).
والخواص الفيزيائية والكيميائية تصنف ايضا الي :
خواص مميزة : وهي
الخواص التي لا تعتمد علي مقدار العينة المأخوذة من المادة فهي تتواجد حتي في جزئ
واحد من المادة ويستفاد منها في الإختبارات الكيميائية للكشف عن المواد .
خواص ممتدة أو
شاملة : وتتوقف علي كمية العينة المأخوذة من المادة مثل الكتلة والحجم.
-
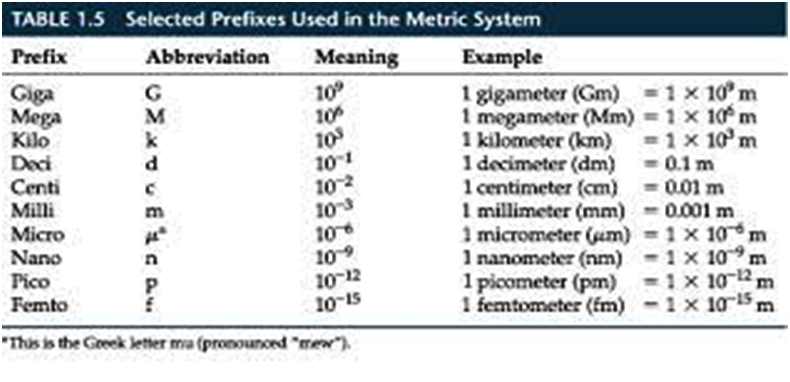
انظمة و وحدات القياس
يوجد العديد من
انظمة القياس ولكن اهمها :-
1-النظام المتري
أو الفرنسي.
2- النظام
الإنجليزي.
3- النظام الدولي
. وهو النظام الأغلب والمعمول به عالميا.
-
الطول والكتلة
الطول لجزء من جسم
ما : هو مقدار الإزاحة التي تصنعها نقطة تسير علي الجسم في اتجاه واحد
(in one dimension) او في اتجاه خط مستقيم بحيث تبدا
من اول هذا الجزء إلي أخره. ويقاس غالبا بالمتر.
اما الكتلة : فهي
مقدار ما يحتويه الجسم من مادة وتقاس بالجرام في النظام المتري وبالـ(slug) في النظام الإنجليزي .
-
درجة الحرارة
أولا يجب أن نفرق
بين الحرارة ودرجة الحرارة .
فالحرارة هي صورة
من صور الطاقة.
أما درجة الحرارة
فهي مقياس لتلك الطاقة التي يحتويها الجسم .أو مقياس لحرارة(طاقة مرتفعة) أو برودة
الجسم (طاقة منخفضة) . وتوضح قيمة درجة حرارة الأجسام الإتجاه الذي تتنتقل فيه
الحرارة بين تلك الأجسام فالحراة تنتقل من الأجسام ذات درجة الحرارة الأكبر إلي
الأجسام ذات درجة الحرارة الأقل.
ولذلك
يكون من الخطأ
القول بأن حرارة المريض 39 ولكن الصحيح أن نقول درجة حرارة المريض 39.
وتقاس درجة
الحرارة بالسليزيوس(الدرجة المئوية) أو الكلفن ( الدرجة المطلقة ) أو الفهرنهايت .
والعلاقة بينهم
كالآتي:
ضع في ذهنك أن
الفهرنهايت أكبر من السليزيوس ولذا نطرح منها 32 أولا ثم نضرب الناتج في كسر أقل
من الواحد 5/9
انتبه: التغير في درجات الحرارة متساوي القيمة علي القياسين السليزي
والكلفن وإليك صورة توضيحة عن المقاييس الثلاثة
-
الكثافة
تعرف علي أنها :
كتلة وحدة الحجوم من المادة. وتحسب من العلاقة Density=mass/volume والوحدة هي جرام لكل سم مكعب .
الكثافة تعبر في
الأساس عن كتلة الجزئ من المادة والمسافة البينية بين الجزيئات . وتتغير عندما
يتغير أحد منهما
فمثلا
لا يتغير وزن
الجزئ(العدد الكتلي)في الظروف العادية إلا بتغير نوع المادة لذا تتوقف الكثافة علي
نوع المادة.
ولا تتغير
المسافات البينية بين الجزيئات للمواد الصلبة والسائلة إلا بتغير درجة الحرارة لذا
تتوقف الكثافة علي درجة الحرارة . أما الغازات فالمسافات البينية بين جزيئاتها غير
ثابتة و تتغير حسب الحجم الذي تتواجد فيه و من ثم فإن كثافتها متغيرة.
-
نسبة الخطأ في الحسابات
تنتج نسبة الخطأ
في حسابات الكيمياء في المعمل من الأخطاء البشرية ودقة الأجهزة ولذا فإنه يتم أخذ مجموعة
من النتائج المتقاربة من التجربة وأخذ المتوسط لها.
-
التحويل بين انظمة القياس يدويا وبالآلة الحاسبة
-
النظام المتري
|
-
النظام الإنجليزي
|
2.54 سم
453.6 جرام
1.6093 كيلو متر
3.79 لتر
|
-
1 انش(بوصة)
-
1 رطل(باوند)
-
1 ميل
-
1 جالون (وحدة قياس
حجوم)
|
اما باستخدام الآلة الحاسبة fx-991
ستجد طريقة التحويل مكتوبة علي غطاء الآلة إذا نسيت
وبهذا نكون قد قدمنا لكم علم الكيمياء وأهم المفاهيم
الإبتدائية به
وهذه المفاهيم تتكرر كثيرا في العلوم الأخري مثل
الفيزياء أيضا
أرجوا ان اكون قد وفقت في الشرح
تحياتي والسلام عليكم
.bmp)
.bmp)

.bmp)

.png)
0 التعليقات :
إرسال تعليق